Conceptos clave
- Nomenclatura y formulación de compuestos orgánicos.
- Grupo funcional.
- Serie homóloga.
- Isomería.
- Reacciones de alcanos, alquenos, alquinos, arenos, haluros de alquilo, alcoholes, aldehidos, cetonas, ácidos carboxílicos, ésteres y amidas.
Objetivos del tema
- Aprender a nombrar compuestos orgánicos sencillos con algún radical
- Comprender el concepto de serie homóloga y su relación con las propiedades físicas de las sustancias orgánicas
- Dar ejemplos de los diferentes tipos de isomería
- Predecir el resultado de las reacciones de sustitución radicalaria (alcanos), adición (alquenos y alquinos), sustitución electrófila aromática (arenos), sustitución nucleófila (halogenoalcanos), eliminación (halogenoalcanos y alcoholes), oxidación (alcoholes y aldehidos) y sustitución nucleófila acílica (ácidos y derivados)
Apuntes de formulación y nomenclatura de compuestos orgánicos
Formulación química v1 from Víctor Manuel Jiménez Suárez
En principio, cualquier compuesto orgánico puede dividirse en cadena, que da al compuesto sus propiedades físicas (punto de fusión y ebullición, solubilidad, ...) y grupos funcionales, que son grupos de átomos que le otorgan sus propiedades químicas particulares. En principio, la química de los grupos funcionales va a ser independiente de la cadena y unos de otros, de modo que si un compuesto tiene dos o más grupos, presentará la química de todos ellos a la vez.
ENLACE1 ENLACE2
Dos compuestos son isómeros si tienen la misma fórmula molecular pero distinta fórmula desarrollada.
Isómeros de cadena: sustancias que difieren en la forma de la cadena.
Isómeros de posición: sustancias que difieren en la posición que ocupa una parte de la molécula.
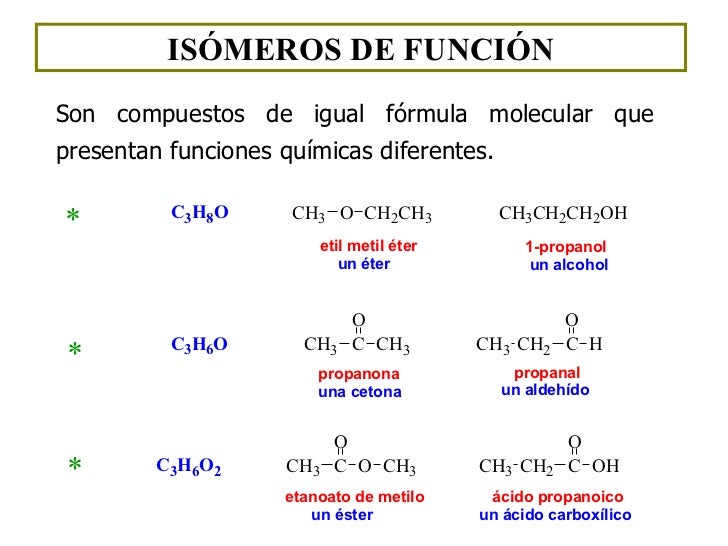
Isómeros de función: sustancias que presentan la misma función en dos posiciones diferentes, de modo que reciben un nombre distinto. Se da entre alcoholes-éteres, aldehídos-cetonas y ácidos-ésteres.
Isómeros geométricos: sustancias con un enlace doble que difieren en la posición que ocupan entre sí los fragmentos unidos a los átomos de carbono enlazados por el doble enlace. Para que se de, además del doble enlace, los fragmentos unidos al mismo carbono no pueden ser iguales.
Isómeros ópticos: sustancias que difieren en la dirección en la que desvían el plano de la luz polarizada. Para que exista, un átomo de carbono debe estar unido a cuatro fragmentos diferentes. Los isómeros ópticos son imágenes especulares no superponibles el uno del otro.
Serie de compuestos consecutivos de la misma familia, que difieren uno del siguiente en un carbono con sus hidrógenos correspondientes. La serie homóloga base de todas las demás es la de los alcanos:
Los alcanos sólo están formados por C y H. Su fórmula general es CnH2n+2. Los cicloalcanos son idénticos salvo que la cadena forma un ciclo. Ambos pueden presentar cadenas o radicales laterales.
La serie homologa de los alcanos se ha presentado arriba.
Tanto los alcanos como los cicloalcanos son compuestos apolares de bajos puntos de fusión y ebullición, debido a que están unidos por fuerzas de London, y por lo tanto son insolubles en agua y solubles en disolventes orgánicos.
Aparte de la combustión, común a todos los compuestos orgánicos, los alcanos y cicloalcanos sólo dan una reacción interesante: la sustitución por radicales libres con halógenos, típicamente cloro, que se realiza en presencia de luz UVA. El resultado de esta reacción no es controlable ni predecible; da varios productos y polisustitución:
Los alquenos tienen al menos un doble enlace entre átomos de carbono y los alquinos, uno triple. Sus fórmulas generales son, respectivamente: CnH2n y CnH2n-2. Alquenos y alquinos tienen similares propiedades físicas a las de los alcanos vistas anteriormente.
La reacción más característica de estas sustancias es la adición al doble o triple enlace. Según la sustancia que se adicione, se suelen denominar de forma distinta, pero la mecánica siempre es la misma: la sustancia en cuestión se divide en dos partes, y cada una de ella se une a uno de los átomos que tenían el doble o triple enlace:
La adición al doble enlace sigue la regla de Markonikov que establece que en el caso de que la sustancia que se adiciona genere un grupo H- (hidrohalogenación e hidratación), éste se une al átomo de carbono que inicialmente tiene ya el mayor número de hidrógenos. Esto explica que en los ejemplos anteriores se formen 2-cloropropano y 2-propanol, y no los productos 1-sustituidos.
Además de esta reacción, los alquenos pueden polimerizarse, convirtiendo el doble enlace en simple y generando así sustancias como el PET, el PP o el PVC:
Los arenos son los hidrocarburos derivados del benceno, y la presencia de éste y sus peculiaridades es lo que los caracteriza. El benceno es una molécula plana en la que los seis átomos de carbono presentan hibridación sp2, y se producen la deslocalización de los 6 electrones del orbital p restante por todo el anillo de forma resonante. Este fenómeno da una especial estabilidad al benceno y se denomina aromaticidad.
La reacción característica de los arenos es la sustitución electrofílica aromática. En esta reacción, una sustancia con apetencia por lo electrones sustituye a uno de los H del anillo de benceno. En función de cuáles sean los reactivos empleados, el electrófilo es uno u otro y la reacción tiene un nombre diferente:
Nota: orto (o-)=1,2; meta (m-)=1,3; para(p-)=1,4.
Los haluros de alquilo o halogenoalcanos sufren ataques de nucleófilos, pues crean sobre el átomo de carbono a que están unidos un déficit de electrones, es decir, una cierta densidad electrónica positiva. Existen muchos nucleófilos que pueden reaccionar con haluros de alquilo, los más interesantes son:
Una segunda reacción que pueden sufrir los haluros de alquilo es la eliminación, que los convierte en alquenos, perdiéndose una molécula del haluro de hidrógeno correspondiente. Esta reacción se realiza utilizando como reactivo potasa alcohólica [KOH(alc)]:
Los alcoholes pueden ser primarios, secundarios o terciarios, según sea el átomo de carbono que lleva el grupo hidroxilo. Se pueden distinguir mediante su oxidación con un oxidante fuerte tipo dicromato o permanganato, pues los alcoholes primarios se van aa oxidar primero a aldehído y luego rápidamente hasta ácido carboxílico; los secundarios a cetonas; y lo terciarios no se oxidan.

Una segunda reacción muy típica de los alcoholes es la deshidratación, que se lleva a cabo con ácido sulfúrico y calor, y que produce un alqueno:
Estos dos tipos de compuestos son isómeros de función, y hay una manera muy simple de distinguirlos, pues los aldehidos son muy fácilmente oxidables, pero las cetonas no. Tradicionalmente se han usado los reactivos de Fehling y Tollens (oxidantes suaves) para probar si el grupo carbonilo es aldehido o cetona en los monosacáridos.
La principal reacción de los ácidos carboxílicos es la esterificación, que es la equivalente en química orgánica a la neutralización: ácido + alcohol = éster + agua:
Si en lugar de usar un alcohol, el ácido reacciona con amoniaco, el resultado es una amida:
La principal característica de las aminas es que son bases de Lewis, gracias al par de electrones no compartidos del nitrógeno. Existen aminas primarias, secundarias y terciarias, según el nitrógeno esté unido a una, dos o tres cadenas carbonadas.
Grupos funcionales
En principio, cualquier compuesto orgánico puede dividirse en cadena, que da al compuesto sus propiedades físicas (punto de fusión y ebullición, solubilidad, ...) y grupos funcionales, que son grupos de átomos que le otorgan sus propiedades químicas particulares. En principio, la química de los grupos funcionales va a ser independiente de la cadena y unos de otros, de modo que si un compuesto tiene dos o más grupos, presentará la química de todos ellos a la vez.
Isomería
ENLACE1 ENLACE2
Dos compuestos son isómeros si tienen la misma fórmula molecular pero distinta fórmula desarrollada.
Isómeros de cadena: sustancias que difieren en la forma de la cadena.
Isómeros de posición: sustancias que difieren en la posición que ocupa una parte de la molécula.
Isómeros de función: sustancias que presentan la misma función en dos posiciones diferentes, de modo que reciben un nombre distinto. Se da entre alcoholes-éteres, aldehídos-cetonas y ácidos-ésteres.
Isómeros geométricos: sustancias con un enlace doble que difieren en la posición que ocupan entre sí los fragmentos unidos a los átomos de carbono enlazados por el doble enlace. Para que se de, además del doble enlace, los fragmentos unidos al mismo carbono no pueden ser iguales.
Isómeros ópticos: sustancias que difieren en la dirección en la que desvían el plano de la luz polarizada. Para que exista, un átomo de carbono debe estar unido a cuatro fragmentos diferentes. Los isómeros ópticos son imágenes especulares no superponibles el uno del otro.
Serie homóloga
Serie de compuestos consecutivos de la misma familia, que difieren uno del siguiente en un carbono con sus hidrógenos correspondientes. La serie homóloga base de todas las demás es la de los alcanos:
Alcanos y cicloalcanos. Sustitución por radicales libres.
Los alcanos sólo están formados por C y H. Su fórmula general es CnH2n+2. Los cicloalcanos son idénticos salvo que la cadena forma un ciclo. Ambos pueden presentar cadenas o radicales laterales.
La serie homologa de los alcanos se ha presentado arriba.
Tanto los alcanos como los cicloalcanos son compuestos apolares de bajos puntos de fusión y ebullición, debido a que están unidos por fuerzas de London, y por lo tanto son insolubles en agua y solubles en disolventes orgánicos.
Aparte de la combustión, común a todos los compuestos orgánicos, los alcanos y cicloalcanos sólo dan una reacción interesante: la sustitución por radicales libres con halógenos, típicamente cloro, que se realiza en presencia de luz UVA. El resultado de esta reacción no es controlable ni predecible; da varios productos y polisustitución:
Cl2, luz
CH3-CH3 ¾¾¾¾® CH3-CH2Cl
+ CH2Cl-CH2Cl+ CHCl2-CH3 + ...Alquenos y alquinos. Adición electrófila al doble enlace.
Los alquenos tienen al menos un doble enlace entre átomos de carbono y los alquinos, uno triple. Sus fórmulas generales son, respectivamente: CnH2n y CnH2n-2. Alquenos y alquinos tienen similares propiedades físicas a las de los alcanos vistas anteriormente.
La reacción más característica de estas sustancias es la adición al doble o triple enlace. Según la sustancia que se adicione, se suelen denominar de forma distinta, pero la mecánica siempre es la misma: la sustancia en cuestión se divide en dos partes, y cada una de ella se une a uno de los átomos que tenían el doble o triple enlace:
- Hidrohalogenación: CH3-CH=CH2
+ HCl ¾® CH3-CHCl-CH3
- Halogenación: CH3-CH=CH2 + Cl2 ¾® CH3-CHCl-CH2Cl
- Hidrogenación: CH3-CH=CH2 + H2 ¾® CH3-CH2-CH3
- CH3-C≡CH + 2 H2 ¾® CH3-CH2-CH3
La hidratación precisa del concurso de un medio ácido, generalmente ácido sulfúrico, y calor.
La adición al doble enlace sigue la regla de Markonikov que establece que en el caso de que la sustancia que se adiciona genere un grupo H- (hidrohalogenación e hidratación), éste se une al átomo de carbono que inicialmente tiene ya el mayor número de hidrógenos. Esto explica que en los ejemplos anteriores se formen 2-cloropropano y 2-propanol, y no los productos 1-sustituidos.
Además de esta reacción, los alquenos pueden polimerizarse, convirtiendo el doble enlace en simple y generando así sustancias como el PET, el PP o el PVC:
Arenos. Sustitución electrofílica aromática.
Los arenos son los hidrocarburos derivados del benceno, y la presencia de éste y sus peculiaridades es lo que los caracteriza. El benceno es una molécula plana en la que los seis átomos de carbono presentan hibridación sp2, y se producen la deslocalización de los 6 electrones del orbital p restante por todo el anillo de forma resonante. Este fenómeno da una especial estabilidad al benceno y se denomina aromaticidad.
- Nitración, con HNO3/H2SO4, se consigue sustituir un -H por un grupo nitro -NO2.
- Sulfonación, con H2SO4, se introduce un grupo -SO3H
- Halogenación, con X2/AlCl3, se introduce un átomo de halogeno -X
- Alquilación de Friedel-Craft, con R-X/AlCl3, se introduce una cadena alquílica -R
- Acilación de Friedel-Craft, con R-CO-X/AlCl3, se introduce una cadena acílica -CO-R
Nota: orto (o-)=1,2; meta (m-)=1,3; para(p-)=1,4.
Haluros de alquilo. Sustitución nucleófila. Eliminación.
Los haluros de alquilo o halogenoalcanos sufren ataques de nucleófilos, pues crean sobre el átomo de carbono a que están unidos un déficit de electrones, es decir, una cierta densidad electrónica positiva. Existen muchos nucleófilos que pueden reaccionar con haluros de alquilo, los más interesantes son:
- OH- ó AgOH, que cambia el halógeno por un grupo hidroxilo, dando lugar a un alcohol
- CN-, dando lugar a nitrilos
- NH3, dando aminas
Alcoholes. Oxidación. Eliminación.
Los alcoholes pueden ser primarios, secundarios o terciarios, según sea el átomo de carbono que lleva el grupo hidroxilo. Se pueden distinguir mediante su oxidación con un oxidante fuerte tipo dicromato o permanganato, pues los alcoholes primarios se van aa oxidar primero a aldehído y luego rápidamente hasta ácido carboxílico; los secundarios a cetonas; y lo terciarios no se oxidan.
Una segunda reacción muy típica de los alcoholes es la deshidratación, que se lleva a cabo con ácido sulfúrico y calor, y que produce un alqueno:
Aldehidos y cetonas. Oxidación.
Estos dos tipos de compuestos son isómeros de función, y hay una manera muy simple de distinguirlos, pues los aldehidos son muy fácilmente oxidables, pero las cetonas no. Tradicionalmente se han usado los reactivos de Fehling y Tollens (oxidantes suaves) para probar si el grupo carbonilo es aldehido o cetona en los monosacáridos.
Ácidos carboxílicos y derivados. Esterificación.
La principal reacción de los ácidos carboxílicos es la esterificación, que es la equivalente en química orgánica a la neutralización: ácido + alcohol = éster + agua:
La reacción de esterificación es un caso especial de reacción de condensación, que es una adición, seguida de una eliminación. En este caso, primero se produce una reacción del oxígeno del alcohol con el carbono del grupo carboxilo, adicionándose a éste y luego, se vuelve a formar el doble enlace C=O al eliminarse una molécula de agua.
Los triglicéridos son el resultado de la esterificación de un triol (glicerina) con ácidos carboxílicos de cadena larga (ácidos grados) dando lugar a las grasas.
Si en lugar de usar un alcohol, el ácido reacciona con amoniaco, el resultado es una amida:
Aminas.
La principal característica de las aminas es que son bases de Lewis, gracias al par de electrones no compartidos del nitrógeno. Existen aminas primarias, secundarias y terciarias, según el nitrógeno esté unido a una, dos o tres cadenas carbonadas.




















que largo
ResponderEliminarlarguisimo
ResponderEliminar