Conceptos clave:
- Concepto de ácido y baseü
- Concepto de pHü
- Fuerza de ácidos y basesü
- Hidrólisis de salesü
- Disoluciones amortiguadoras
- Titulación ácido-baseü
Objetivos:
- Definir ácidos y bases según Arrhenius, Brönsted y Löwry y Lewisü
- Aprender a calcular el pH de ácidos y bases fuertes y débilesü
- Predecir cualitativamente el carácter ácido o básico de una disolución de una salü
- Realizar una titulación ácido-baseü
- Realizar cálculos estequiométricos con reacciones de neutralizaciónü
1. Concepto de ácido y base.
1.1. Definición de Arrhenius
Ácido según Arrhenius es toda sustancia que, en solución acuosa, es capaz de liberar iones H+. Por ejemplo, el ácido clorhídrico, HCl, o el ácido nítrico, HNO3.
Base según Arrhenius es toda sustancia que, en solución acuosa, es capaz de liberar iones OH-. Por ejemplo, el hidróxido sódico, NaOH, o el hidróxido potásico, KOH.
1.2. Definición de Brönsted-Lowry.
Ácido según Brönsted-Lowry es toda especie química (molécula o ión) que es capaz de ceder protones a otra especie química.
Base según Bronsted-Lowry es toda especie química (molécula o ión) que es capaz de captar protones.
1.3. Definición de Lewis.
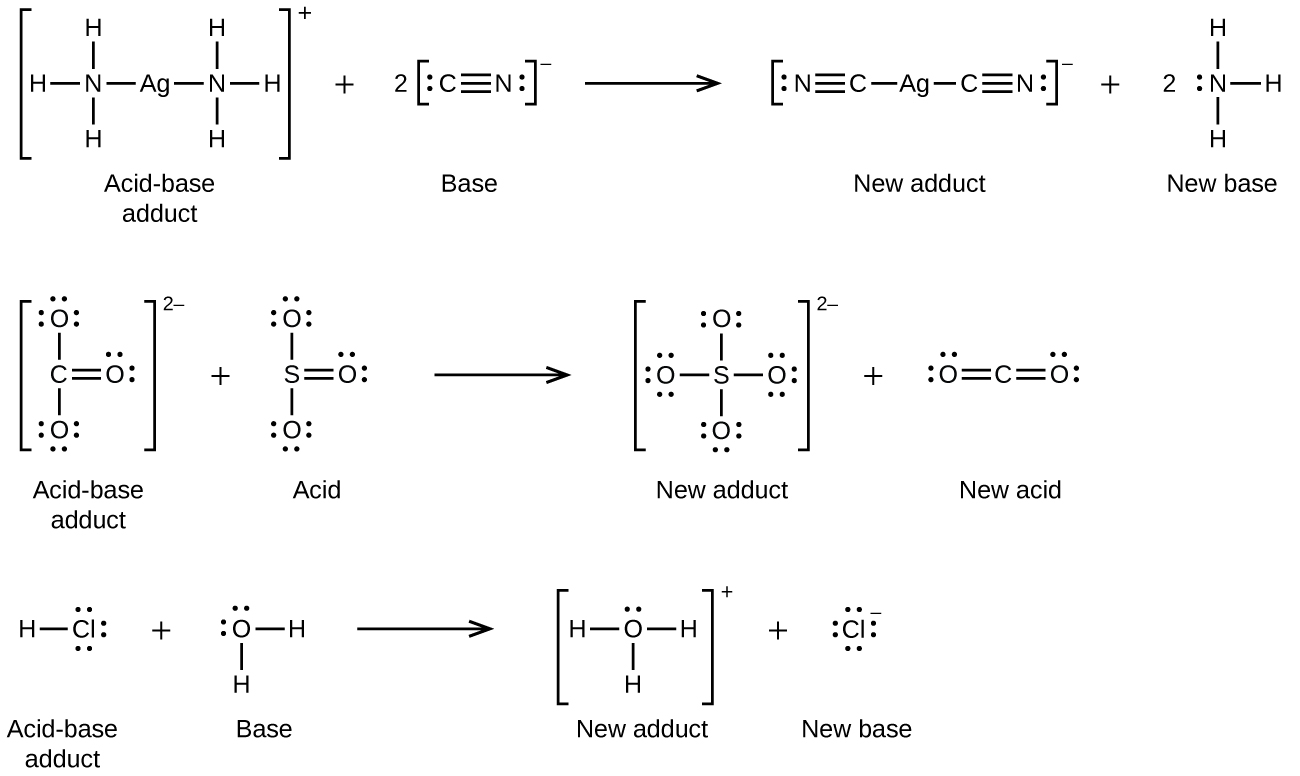
Ácido: un ácido de Lewis se define como una sustancia capaz de aceptar un par de electrones.
Base: una base de Lewis es una sustancia con capacidad para compartir o dar pares de electrones.
De este modo, todas las sustancias que para las teorías de Arrhenius o Bronsted-Lowry, eran ácidos, para Lewis también lo son, ya que coinciden con su teoría, sólo que, Lewis amplía el concepto de ácido más allá de las anteriores teorías, pues según Bronsted, una base es una sustancia aceptora de protones, pero éste caso es tan sólo un caso particular para las bases de Lewis, pues para él, las sustancias con protones, son ácidos. Pero muchos ácidos de Lewis, no lo son de Bronsted, como por ejemplo, BF3 (BF3 + :NH3 → F3B-NH3).
También existen sustancias de Lewis, que pueden actuar como ácidos, y bases a la vez, estas son sustancias conocidas como anfóteras (por ejemplo, el óxido de aluminio).
2. Equilibrio de autodisociación del agua. Escala de pH.
Algunas moléculas de agua sufren un proceso de autoionización que consiste en que un ión hidrógeno (H+) de una molécula de agua se disocia de su átomo de oxígeno, al que se encuentra unido covalentemente, y pasa a unirse con el átomo de oxígeno de otra molécula de agua vecina, con el que estaba unido con un puente de hidrógeno. Se forman, por tanto, un ión de H3O+ y otro ión OH-. Esta es la razón por la que la molécula de agua no es un líquido químicamente puro, sino que es una solución iónica.
H2O + H2O D H3O+ + OH-
En el agua pura, a 25ºC se cumple que:
KW=[H3O+]·[OH-]=10-14; [H+]=[OH-]=10-7 M
*Por convenio, se usa H+ en lugar de H3O+
Esto significa que en este caso es químicamente neutra. Sin embargo, cuando se disuelve un ácido en agua, la concentración de H+ aumenta, mientras que si se disuelve una base disminuye.
La escala del pH fue ideada por el bioquímico Sorensen para evitar cálculos complejos:
pH=log1/[H+]=-log[H+]
Por tanto, el pH del agua pura es 7. Los valores de pH pueden variar entre 0 y 14. El pH 7 corresponde a las disoluciones neutras, menores de 7 y hasta 0, disoluciones crecientemente ácidas y hasta 14 crecientemente alcalinas. Como la escala del pH es logarítmica en base 10, si el valor del pH varía una unidad, la cantidad de protones aumenta o disminuye 10 veces.
3. Fuerza de ácidos y bases
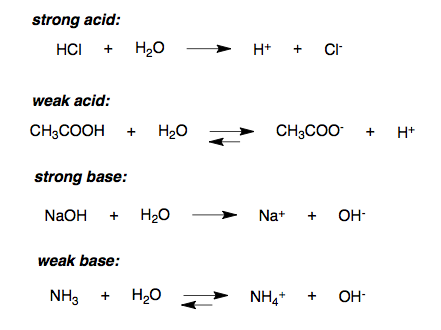
La fuerza relativa de los ácidos y de las bases depende de su mayor o menor tendencia a ceder o aceptar iones H+. En disoluciones acuosas diluidas ([H2O] ≅ constante) la fuerza de un ácido HA depende de la constante de equilibrio:
AH + H2O DA- + H3O+
A Ka se le llama constante de disociación o constante de acidez. Según su valor hablaremos de ácidos fuertes o débiles: Si Ka > 100, el ácido es fuerte y estará disociado casi en su totalidad. Si Ka < 1 el ácido es débil y estará sólo parcialmente disociado. Cuanto mayor sea la fuerza del ácido o de la base, más desplazado estará el equilibrio en el sentido de disociación, y mayor será el valor de sus respectivas constantes de ionización.
Otra manera de expresar la fortaleza de un ácido o base es dando su grado de disociación, aunque éste depende de la concentración. Se define el grado de disociación como el cociente entre la cantidad de sustancia disociada y la cantidad inicial, pudiéndose indicar como tanto por ciento.
Simulación de ácidos y bases fuertes y débiles
Ejercicio resuelto: Cálculo del pH de mezcla de una disolución ácido y base
Ejercicio resuelto: Cálculo del pH de una base débil a partir de su valor de Kb
4. Reacciones de hidrólisis
Las reacciones de hidrólisis son las que dan las sales procedentes de ácidos y/o bases débiles. Se pueden entender atendiendo al concepto de par conjugado de Brönsted-Lowry, ya que cuanto más fuerte sea un ácido, más débil será su base conjugada y al revés: cuanto más débil el ácido, más fuerte su base conjugada. Así que una sal que contenga un ión procedente de un ácido o base débil tendrá también a su vez características ácido base.4.1. Sales de ácido y base fuerte
En estos casos, no hay hidrólisis, pues ambos iones son ácido y base muy débiles, y no interaccionarán con el agua. Es el caso del NaCl, por ejemplo.4.2. Sales de ácido fuerte y base débil
El pH de la disolución resultante de disolver una sal de base débil y ácido fuerte es ligeramente ácido, pues el catión procedente de la base débil tiene carácter ácido (es el ácido conjugado de dicha base débil), por lo que dará lugar a un equilibrio ácido base con el agua, desprotonándose, y liberando iones hidronio H3O+ a la disolución. Es el caso del NH4Cl.
NH4Cl ® NH4+
+ Cl-
NH4+ + H2O D NH3 +
4.3. Sales de ácido débil y base fuerte
En este caso el pH es ligeramente básico debido al carácter básico del anión de la sal. Es el caso del acetato de sodio, por ejemplo:
CH3COONa ® Na+ + CH3COO-
CH3COO-
+ H2O D CH3COOH + OH-
4.4. Sales de ácido y base débiles [CONTENIDO ADICIONAL NO EVALUABLE]
En estos casos, ambos iones sufren hidrólisis, y el pH resutlante dependerá de la extensión de cada una de las reacciones. A efectos prácticos, si Ka>Kb será ácido y si Ka<Kb, será básico. Es el caso del NH4CN.5. Reacción de neutralización. Valoración ácido-base. Indicadores.
Una neutralización es la reacción entre un ácido y una base, produciéndose una sal y agua:
HCl + NaOH ®
NaCl + H2O
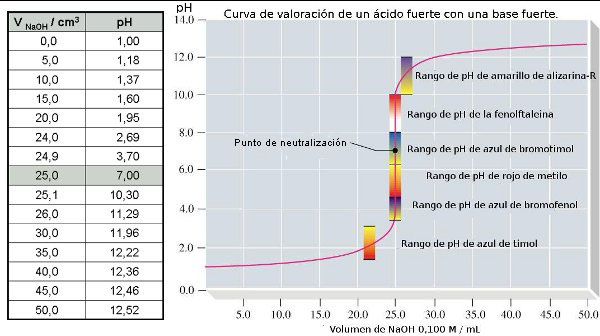
La valoración o volumetría ácido-base es una técnica que permite calcular la concentración de un ácido (o de una base) disueltos, haciendo reaccionar un volumen del mismo con otro volumen de una disolución básica (o ácida) de concentración conocida. Al menos una de las dos sustancias debe ser un electrolito fuerte. Para realizar la valoración se mezclan gradualmente el ácido y la base en presencia de un indicador que muestra el momento en que se puede dar por finalizada la reacción de valoración (punto final), generalmente mediante un cambio de color. Los indicadores suelen ser compuestos orgánicos que cambian de color según el pH del medio (zona de viraje). El punto en el que se han añadido la cantidad estequiométrica de base (o ácido) que neutraliza exactamente al ácido (o base) iniciales se denomina punto de equivalencia de la titulación. Si se elije bien el indicador, el punto final coincide en la práctica con el punto de equivalencia.
A título indicativo:
- Para ácidos y bases fuertes, se pueden usar indicadores cuya zona de viraje esté entre pH 4 y pH 9.
- Para titulaciones de bases débiles, se deben usar indicadores que viren a pH ácido, pues el punto de equivalencia corresponde a un sal de base débil, a la que le corresponde un pH ácido.
- Para titulaciones de ácidos débiles, se usan indicadores que viran a pH básico, pues el punto de equivalencia corresponde a una sal de ácido débil, a la que le corresponde un pH básico.
A efectos prácticos, la zona de viraje del indicador es de pKin±1, donde Kin es la constante ácido-base del indicador en cuestión.
Simulador de una titulación ácido-base
Simulador de una titulación ácido-base
Simulador de una titulación ácido-base
6. Disoluciones tampón. [CONTENIDO ADICIONAL NO EVALUABLE]
Las disoluciones reguladoras, tampón o amortiguadoras se basan en el efecto del ion común. Buscan mantener constante el pH frente a pequeñas adiciones de ácidos y bases. Están constituidas por un ácido débil y una sal de su base conjugada o por una base débil y la sal de su ácido conjugado con concentraciones similares en ambos casos.
Cuando se añade un ácido, éste reacciona con la base del sistema y produce ácido, haciendo que globalmente cambien un poco las concentraciones de ambos, pero puesto que el pH depende de ambos, el efecto sobre éste es pequeño.
Problemas ácido base v1 from Víctor Manuel Jiménez Suárez
7. Bibliografía
Fernández López, P. (2015). Equilibrio ácido-base. Retrieved 23 March 2015, from http://www.uclm.es/profesorado/pablofernandez/QG-05-equilibrio%20acido%20base/equilibrio%20acido%20base.pdf
Juntadeandalucia.es,. (2015). FÍSICA Y QUÍMICA. Retrieved 23 March 2015, from http://www.juntadeandalucia.es/averroes/recursos_informaticos/concurso2005/06/segundobachquim.htm
Mallen, M. (2015). Manual de Química Analítica. Retrieved 23 March 2015, from http://www.uia.mx/campus/publicaciones/quimanal/pdf/5reaccionesneutralizacion.pdf
Quimica.laguia2000.com,. (2010). Ácido-base, según Lewis | La Guía de Química. Retrieved 23 March 2015, from http://quimica.laguia2000.com/conceptos-basicos/acido-base-segun-lewis#ixzz3UkHeF599
Quimica.laguia2000.com,. (2010). Reacciones de neutralización | La Guía de Química. Retrieved 23 March 2015, from http://quimica.laguia2000.com/reacciones-quimicas/reacciones-de-neutralizacion
Quimitube.com,. (2015). Hidrólisis sal de base fuerte y ácido débil | Quimitube. Retrieved 23 March 2015, from http://www.quimitube.com/videos/teoria-6-3-hidrolisis-bfuerte-adebil
Quimitube.com,. (2015). Química ácido base: concepto de ácido y de base | Quimitube. Retrieved 23 March 2015, from http://www.quimitube.com/videos/teoria-1-concepto-de-acido-y-de-base
YouTube,. (2015). QUIMICA Ácido Base T6.3 Hidrólisis - Base fuerte Ácido débil. Retrieved 23 March 2015, from https://www.youtube.com/watch?v=rLuGnndzRIY
YouTube,. (2015). QUIMICA Ácido Base T6.5 Hidrólisis - Base débil Ácido débil. Retrieved 23 March 2015, from https://www.youtube.com/watch?v=HiX43QpjEJw
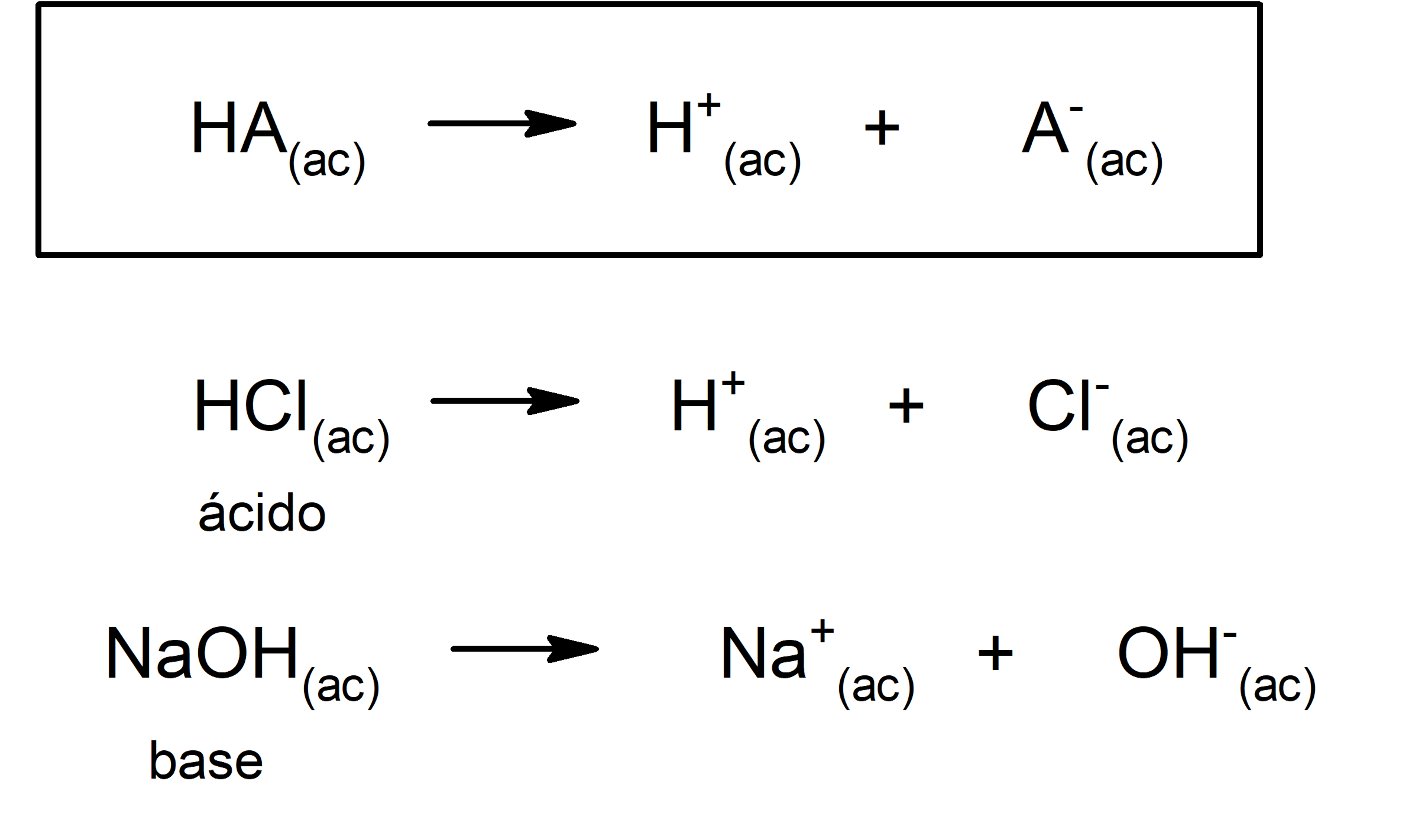



No hay comentarios:
Publicar un comentario