Conceptos clave:
- Velocidad de reacción: definición y factores de los que depende ü
- Ecuaciones de las cinéticas de orden 0, 1 y 2 ü
- Procesos elementales vs. mecanismos de reacción ü
- Ecuación de Arrhenius ü
- Teoría de colisiones: conceptos básicos ü
- Teoría del complejo activado: conceptos básicos ü
- Catalizadores ü
Objetivos del tema:
- Definir velocidad de reacción ü
- Describir la influencia de los diferentes factores sobre la velocidad de reacción ü
- Distinguir entre orden de reacción parcial y total y molecularidad ü
- Averiguar ecuaciones de velocidad a partir de datos experimentales ü
- Aplicar la ecuación de Arrhenius ü
- Realizar esquemas de reacciones (exotérmicas, endotérmicas, rápidas, lentas, catalizadas, no catalizadas) ü
- Describir el efecto de los catalizadores ü
Velocidad de reacción
Sea una reacción genérica:
a A + b B -----> p P + q Q
Se define velocidad de reacción, v, como:
La velocidad de reacción depende de cuatro factores:
- concentración/presión: cuanto mayor sea, mayor será la velocidad, debido a que hay más oportunidades para que se de la reacción
- temperatura: experimentalmente se constata que todas las reacciones van más rápido a mayor temperatura
- grado de división: cuanto mayor sea la superficie de contacto entre los reactivos, mayor será la velocidad de reacción
- catalizadores: los catalizadores aceleran las reacciones actuando sobre el mecanismo de la misma
Efecto de la concentración. Órdenes de reacción.
Experimentalmente, se ha encontrado que la velocidad de las reacciones químicas puede representarse por una ecuación del siguiente tipo (Ecuación de Guldberg y Waage):
v=kv·[A]α·[B]β
a y ß se denominan órdenes parciales de reacción respecto a A y B, respectivamente, a+ß es el orden total; kv es la constante de velocidad, que sólo depende de la temperatura
Cuando se trata de estudiar la cinética de una reacción, se procura aislar el efecto de cada reactivo, y la manera más simple es poner una gran exceso de todos los demás, de modo que su variación sea despreciable. De ese modo, la ecuación de arriba se queda como
v=k'v·[A]α
Una vez obtenidos los órdenes parciales, se hacen otra serie de experimentos para determinar la constante de velocidad.
Habitualmente, se estudia cómo varía la concentración del reactivo A con el tiempo, y una vez que se obtienen los datos, se hacen las representaciones gráficas de [A] vs t, L[A] vs t, y 1/[A] vs t. Aquella en la que los datos se acomoden mejor indica el orden parcial correspondiente al reactivo A.
Desafortunadamente, no es infrecuente que los datos tengan una incertidumbre tal que haga difícil realizar la elección anterior con garantías. En esos casos, no queda otra que volver al laboratorio y tratar de obtener más y mejores datos.
Virtual Chemistry ExperimentsProcesos elementales. Mecanismos de reacción.
Es poco frecuente que una reacción química ocurra en una sola etapa y tal y como se escribe. Lo habitual es que ocurran mediante un mecanismo de reacción. Se denomina mecanismo de reacción a la descripción de las etapas por las que se desarrolla un proceso químico global.
Cada una de las etapas que conforman un mecanismo de reacción se denomina proceso elemental, y el número de moléculas que interviene en un proceso elemental se llama molecularidad. Los procesos elementales presentan molecularidad 1 o 2.
La siguiente reacción ocurre en un solo paso:
H2
+ I2 ---> 2 HI
La misma reacción, pero con bromo o cloro ocurre mediante un
mecanismo complejo:
Cl2
+ UVA ---> 2 Cl
Cl +
H2 ---> HCl + H
H + Cl2 ---> HCl + Cl
H + H ---> H2
Cl + Cl ---> Cl2
H + Cl ---> HCl
Global:
H2 + Cl2 + UVA ---> 2 HCl
Efecto de la temperatura. Ecuación de Arrhenius.
La constante de velocidad sólo depende de la temperatura, y la
ecuación que describe esa
dependencia se debe a Svante Arrhenius:
kv=A·e-Ea/RT
donde A es el factor preexponencial, Ea es la energía
de activación (energía mínima para que una reacción tenga lugar) y T la
temperatura. Como puede verse, la ecuación predice que un incremento de la temperatura implica un incremento de la constante de velocidad, y por
ello de la velocidad.
Una representación gráfica del logaritmo neperiano de la constante
de velocidad frente al inverso de la temperatura debe ser lineal y la pendiente permite el cálculo de la energía
de activación:
L(kv)=L(A)
- Ea/RT
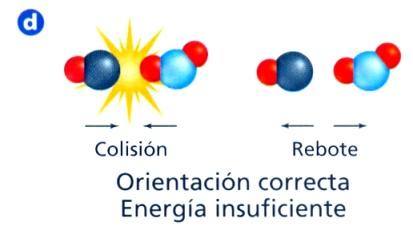
Teoría de colisiones.
Establece que para que ocurra una reacción, los reactivos deben colisionar entre sí con una energía suficiente (energía de activación) y una orientación adecuada.
La energía cinética marca el umbral a partir del cual las moléculas pueden colisionar de manera efectiva. Una mayor temperatura aumenta la fracción de partículas que superan esa energía. Pincha en la imagen para ir a un simulador.
En relación con la ecuación de Arrhenius, el factor preexponencial A es el que tiene en cuenta las colisiones con la geometría adecuada para que se produzca la reacción, mientras que evidentemente el factor exponencial que contiene la energía de activación, es el que da cuenta de la mínima energía necesaria para que la colisión se efectiva.
La teoría de colisiones no permite predecir la energía de activación, que es un parámetro que hay que introducir de manera experimental, pero sí puede predecir el factor preexponenecial, lo que nos da una herramienta para validarla. El resultado no es bueno: hay muy pocas reacciones para las que lo predicho por la teoría de colisiones sea similar al resultado experimental. Es un resultado lógico, habida cuenta de lo elemental de la teoría, que prescinde de cualquier elemento mecanocuántico, que debe estar presente en cualquier teoría moderna sobre los átomos y moléculas y su comportamiento.
Teoría del complejo activado.
Esta teoría postula la formación de una estado de transición intermedio entre reactivos y productos en el que los enlaces ni se han roto ni se han formado. Este estado de transición es el complejo activado, la diferencia entre su energía y la de los reactivos sería la energía de activación. El complejo activado es modelable teóricamente, lo que permite cotejar valores con la práctica.
Catálisis.
Los catalizadores son sustancias que aceleran la reacción, cambiando su mecanismo, de modo que abren una nueva vía de menor energía de activación. El catalizador se regenera, por lo que no aparece en la reacción global, y no hacen falta grandes cantidades.
La catálisis puede ser homogénea, si todas las sustancias, incluida el catalizador están en la misma fase (por ejemplo, la catálisis enzimática) o heterogénea si el catalizador no está en la misma fase que los reactivos (típicamente será un sólido).
Kinetic problems set
Kinetic problems set



No hay comentarios:
Publicar un comentario