Conceptos clave:
- Enlace iónicoü
- Energía reticularü
- Ciclo de Born-Haberü
- Enlace covalenteü
- Estructuras de Lewisü
- Teoría de enlace por valencia (TEV)ü
- Hibridaciónü
- VSEPRü
- Polaridad de las moléculasü
- Enlace metálicoü
- Enlace intermolecularü
- Puentes de hidrógenoü
- Fuerzas de Van der Wallsü
- Interacción dipolo-dipoloü
- Fuerzas de Londonü
- Relación enlace-propiedadesü
Objetivos del tema:
- Definir enlace iónico y energía reticularü
- Calcular y comparar energías reticulares por la ecuación de Born-Landé y por el ciclo de Born-Haberü
- Describir los fundamentos de la teoría de enlace por valenciaü
- Predecir la geometría, tipos de enlace, hibridación y polaridad de moléculas e iones usando la VSEPR combinada con la TEV-OHü
- Describir el modelo del gas electrónico para el enlace metálicoü
- Describir y distinguir las distintas interacciones intermolecularesü
- Asociar distintas moléculas con el enlace intermolecular que le corresponde según su estructura y polaridadü
- Asociar propiedades macroscópicas y enlaceü
Enlace iónico
Cuando dos átomos de elementos de muy diferente electronegatividad se aproximan, el más electronegativo es capaz de arrancarle uno o más electrones al otro, formándose así sendos iones de distinto signo, que a continuación, se atraen por medio de fuerzas electrostáticas de Coulomb. Generalmente, los iones resultantes suelen cumplir la regla del octeto.
Naturalmente, esto no ocurre entre dos átomos, sino que es un fenómeno que implica un enorme número de ellos, y el resultado es un compuesto sólido, en el que los iones están distribuidos por la estructura de manera que la energía de interacción se minimiza, teniendo en cuenta fundamentalmente dos factores: la carga de los iones (que determina la estequiometría del compuesto) y su tamaño relativo.
Hay muchos tipos de estructuras iónicas, y cada compuesto tiene la suya típica, pudiendo en algunos casos, existir incluso más de una:
El enlace iónico es muy fácil de modelizar, debido a que es posible cuantificar las interacciones entre los átomos mediante la ley de Coulomb. Al hacerlo, resulta una expresión matemática para la magnitud que va a medir dicha interacción: la energía reticular. Se denomina energía reticular a la energía desprendida cuando se forma un mol de compuesto iónico sólido a partir de los iones en fase gaseosa.
CONTENIDO NO INCLUIDO EN PAU:
Donde:
- K=9·109 N·m2/C2, constante electrostática
- A: constante de Madelung, típica de cada estructura (ver tabla abajo)
- NA=6.02·1023, número de Avogadro
- Z+, Z-: cargas de los iones
- e=1.6·10-19 C, carga del electrón
- d0: distancia interiónica
- n=parámetro de compresibilidad de la red, que depende de las configuraciones electrónicas de los iones (ver tabla abajo)
La constante de Madelung "cuenta" las infinitas interacciones tanto atractivas como repulsivas que aparecen en el sólido iónico conforme nos vamos alejando de un ion dado, agrupando los iones en esferas concéntricas de radio creciente. Tanto los radios de estas esferas como el número de iones de cada tipo en cada una de ellas, se pueden determinar geométricamente resultando series numéricas cuya suma es la citada constante de Madelung.
Estructura
|
Constante de Madelung
|
NaCl
|
1.7476
|
CsCl
|
1.7627
|
ZnS
(blenda)
|
1.6380
|
ZnS
(wurtzita)
|
1.6413
|
CaF2
|
2.5194
|
TiO2
|
2.3850
|
Tipo de ión
|
Ejemplo
|
n
|
He
|
LiH
|
5
|
Ne
|
NaF, MgO
|
7
|
Ar
|
KCl, CaS, CuCl
|
9
|
Kr
|
RbBr, AgBr
|
10
|
Xe
|
CsI
|
12
|
Calculador de energías reticulares
Lo más importante de esta expresión es que muestra que los parámetros críticos que determinan la energía reticular son, en este orden: el producto de las cargas y la distancia interiónica.
Los valores de energía reticular calculados con esta expresión no se pueden cotejar directamente con valores experimentales, debido a que no es posible medir directamente esta magnitud. Sin embargo, se pueden obtener valores semiempíricos mediante un ciclo termodinámico denominado ciclo de Born-Haber. Por ejemplo, para el NaCl:
Lo más importante de esta expresión es que muestra que los parámetros críticos que determinan la energía reticular son, en este orden: el producto de las cargas y la distancia interiónica.
Los valores de energía reticular calculados con esta expresión no se pueden cotejar directamente con valores experimentales, debido a que no es posible medir directamente esta magnitud. Sin embargo, se pueden obtener valores semiempíricos mediante un ciclo termodinámico denominado ciclo de Born-Haber. Por ejemplo, para el NaCl:
Problemas enlace iónico
Los compuestos iónicos suelen tener puntos de fusión altos, debido a los altos valores de energía reticular; son duros (resistencia a ser rayados), por la misma razón; suelen ser solubles en agua; son aislantes térmicos y eléctricos, aunque en estado fundido o en disolución sí conducen la electricidad; por último son frágiles, pues leves deformaciones de la red enfrentan entre sí a iones del mismo signo, generando repulsiones que rompen el cristal. El valor de la energía reticular determina estas propiedades, de modo que cuanto mayor es ésta, mayor será el punto de fusión y la dureza, por ejemplo.
Enlace covalente
Las primeras ideas sobre el enlace covalente corresponden a Lewis, quien observó que los átomos trataban de adquirir una configuración electrónica externa similar a la de los gases nobles, bien adquiriendo o perdiendo electrones, bien compartiendo, como en el caso del enlace covalente. De ahí nace la noción de octete electrónico, aún usada hoy en día, si bien con matices como veremos, y las estructuras de Lewis.
Estructuras de Lewis
Son representaciones planas de los enlaces en la molécula, realizadas con la premisa de que debe completarse el octete electrónico para todos los átomos presentes.
En la práctica, el octete electrónico sólo se cumple estrictamente en elementos del primer periodo, concretamente C, N, O y F; en el caso del B o el H, el octete electrónico no puede alcanzarse por déficit de electrones; y en el resto de los elementos, es posible superarlo ampliamente (esto se llamó expansión del octete, pero esa es una idea obsoleta hoy en día).
A la hora de hacer estructuras Lewis de moléculas, se debe escoger como más adecuada aquella que tenga menos carga formal, aunque ello implique incumplir la regla del octete. La carga formal se determina repartiendo equitativamente los electrones compartidos entre los átomos y comparando con la configuración de valencia original.
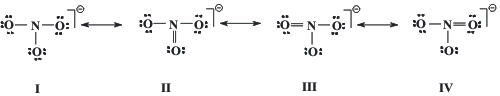
Cuando tratamos con especies con enlaces múltiples, es posible que existan varias opciones respecto a dónde colocar tales enlaces. Ese fenómeno se llama resonancia y cada una de las representaciones que tratan de describir a la especie química, forma de resonancia. No debe interpretarse que la molécula es a veces una cosa y a veces otra, o que algunas moléculas son de un tipo y otras de otra, la resonancia trata de representar que los enlaces no son ni simples ni múltiples sino intermedios, pero siendo todos los implicados idénticos entre sí e indistinguibles (ver otras explicaciones en esta WEB).
En esta WEB podéis ver más ejemplos y ejercicios al respecto de las estructuras Lewis y la resonancia.
Teoría de enlace por valencia (TEV)
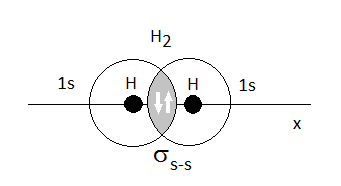
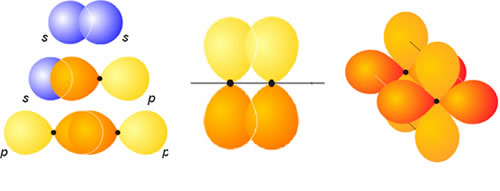
Esta es la primera teoría "cuántica" del enlace covalente. Se basa en la idea de que para eu se forme un enlace covalente, los átomos deben acercarse de modo que los orbitales de la capa de valencia solapen en el espacio, así, los electrones dejarían de estar descritos exclusivamente por la función de onda correspondiente a uno de los átomos para pasar a serlo por una combinación de ambas:
f1 f2 Y=C1·f1 + C2·f2
Si el enlace resultante tiene simetría cilíndrica, como es el caso del H2, se dice que el enlace es s (sigma). Si por el contrario, tiene un plano de simetría, lo llamaremos p (pi).
El problema de los orbitales atómicos es que carecen de direccionalidad, no apuntan a ningún punto concreto del espacio. La solución a este problema viene de la mano de un artificio matemático denominado hibridación, y que consiste en combinar matemáticamente orbitales atómicos de un átomo para obtener otros orbitales atómicos esta vez con direccionalidad:
Hibridación
La TEV es insuficiente cuando se trata de predecir la estructura de las moléculas. Esto es claro cuando se intenta explicar el enlace en la molécula de agua, que resultaría tener un ángulo de enlace de 90º cuando es sabido que es de 104,5º:
Merece la pena revisar el caso del átomo de carbono, base de la química orgánica, que puede presentar las tres primeras hibridaciones, y en función de ella, cambia la geometría en torno a esos átomos de carbono y por ende, su reactividad.
Etano, CH3-CH3
Eteno, CH2=CH2
Etino, CHºCH
Teoría de la repulsión de los pares de electrones de la capa de valencia (Valence Shell Electron Pair Repulsion, VSEPR)
A pesar de lo anterior, la TEV-OH sólo consigue explicar la forma de las moléculas a posteriori, es decir, una vez que sabemos qué forma tiene la molécula, le asignamos la hibridación que es más idónea para explicarla. Para predecir la forma de las moléculas, emplearemos la aproximación de la VSEPR.
Esta teoría se basa en la suposición de que los pares de electrones alrededor de un átomo se tratarán de colocar los más alejados posibles unos de otros para minimizar las repulsiones entre ellos.
Los pares de electrones se dividen en dos grupos, aquellos que forman enlaces y que unen átomos, y los que no; los primeros se denominan pares de enlace (X) y los segundos, pares de no enlace (E). A efectos de la VSEPR, los enlaces múltiples cuentan como un solo par.
Una vez que hemos dividido los electrones en pares, la geometría básica está determinada, y luego la intensidad relativa de las repulsiones entre los distintos pares, la modificará ligeramente. Para ello se debe tener en cuenta que los pares de no enlace se repelen con más intensidad entre sí que con los de enlace, y éstos entre sí son los que menos se repelen: E-E>E-X>X-X (Ver tutorial en esta WEB).
Prueba este SIMULADOR que aplica el modelo VSEPR a varias especies que luego a aparecen en la hoja de problemas.
Todo lo que hemos visto hasta ahora en cuanto a enlace covalente, corresponde a sustancias que forman moléculas. sin embargo, existen otra sustancias, cuyos átomos también se unen entre sí por enlaces covalentes, formando estructuras tridimensionales extendidas sin que existan moléculas. Estas sustancias, llamadas a veces compuestos covalentes gigantes o reticulares, tienen propiedades radicalmente diferentes a los compuestos covalentes moleculares, pues las de éstos viene determinada por la intensidad de las fuerzas intermoleculares que veremos más adelante. Algunas de estas sustancias coavlentes reticulares son el diamante o el grafito (ambos son formas alotrópicas del carbono), el silicio (Si), el cuarzo (SiO2)
Alótropos del carbono
Cuarzo, SiO2
Los compuestos covalentes reticulares son muy duros (el diamante es la sustancia más dura de la Tierra), pero no son frágiles como los iónicos; tienen puntos de fusión muy altos, son aislantes térmicos y eléctricos (hay excepciones a esto, como el grafito, por ejemplo) y no suelen ser solubles en ningún tipo de disolvente.
Enlace metálico
El enlace metálico es el resultado de la interacción eléctrica entre los electrones de valencia deslocalizados de los átomos metálicos y los "restos positivos" que quedan una vez desprendidos los electrones de valencia. Este modelo se denomina modelo del gas electrónico o del mar de electrones.
El modelo descrito es capaz de explicar cualitativamente las propiedades de los metales: alto punto de fusión, conductividad eléctrica y térmica, brillo característico, ductilidad y maleabilidad; sin embargo no resiste su confrontación con los valores cuantitativos de dichas propiedades, fracasando estrepitosamente en su predicción.
El modelo que realmente permite una aproximación cuantitativa y global al enlace metálico, y también al iónico y a los sólidos covalentes reticulares, es la teoría de bandas. Dicha teoría es una extensión de la teoría de orbitales moleculares que se emplea para explicar el enlace covalente en las moléculas, y parte de la premisa de que cuando un gran conjunto de átomos metálicos se unen entre sí, se produce una superposición de los orbitales atómicos de todos ellos generando una conjunto de estados cuánticos nuevos cuyas energías están muy próximas entre sí, generando una banda continua de orbitales de energía creciente, de los que sólo algunos estarán ocupados. El modelo general, a grandes rasgos, genera dos bandas: una ocupada por electrones, denominada Banda de Valencia (BV) y otra vacía denominada Banda de Conducción (BC). En el caso de los metales, ambas bandas están unidas, de modo que los electrones de la BV se pueden mover con libertad por la BC, explicando así la conductividad eléctrica de los metales, pero además, los semiconductores y aislantes también entran en este modelo. En estos materiales, las bandas están separadas por una banda de energía prohibida llamada en inglés Band Gap siendo la diferencia entre ambos materiales el tamaño de este gap. En los semiconductores, el gap se puede salvar con 1-2 eV, de modo que la conductividad es dependiente de la temperatura. En los aislantes, la diferencia es muy grande y la conductividad de facto es casi nula e independiente de la temperatura.
Enlace intermolecular
Las propiedades de los compuestos covalentes moleculares está determinada por la fortaleza de las interacciones que se desarrollan entre sus moléculas. Las interacciones moleculares se pueden clasificar del siguiente modo:
- Puentes de hidrógeno
- Fuerzas de Van der Waals
- Dipolo-dipolo
- Dipolo-dipolo inducido
- Dipolo instantáneo-dipolo instantáneo o de London
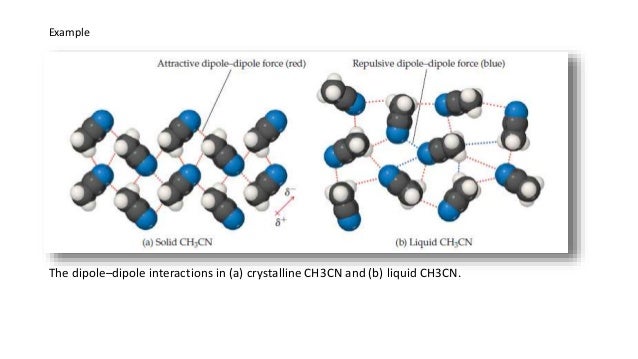
Las interacciones dipolo-dipolo se da entre moléculas polares como el HCl o PCl3, por ejemplo. Son similares a los puentes de hidrógeno, pero menos intensas.
Finalmente, las interacciones dipolo instantáneo-dipolo instantáneo o de London son universales y se producen como consecuencia del movimiento caótico de los electrones de las moléculas, que, en un instante dado, producen una separación de carga que resulta en un pequeño dipolo que interacciona con los demás que se generan en otras moléculas. A pesar de ser las más débiles de las interacciones, son importantes en bioquímica, debido a que las fuerzas de London aumentan con el tamaño y las biomoléculas son muy grandes. También son responsables del aumento del punto de fusión de sustancias apolares como los hidrocarburos, los halógenos o los gases nobles.
Las interacciones dipolo-dipolo inducido se dan en mezclas de sustancias y por ello no las consideraremos aquí.
Finalmente, las interacciones dipolo instantáneo-dipolo instantáneo o de London son universales y se producen como consecuencia del movimiento caótico de los electrones de las moléculas, que, en un instante dado, producen una separación de carga que resulta en un pequeño dipolo que interacciona con los demás que se generan en otras moléculas. A pesar de ser las más débiles de las interacciones, son importantes en bioquímica, debido a que las fuerzas de London aumentan con el tamaño y las biomoléculas son muy grandes. También son responsables del aumento del punto de fusión de sustancias apolares como los hidrocarburos, los halógenos o los gases nobles.
Relación enlace-propiedades
Como hemos ido viendo a lo largo del tema, las propiedades de las sustancias están íntimamente relacionadas con el tipo de enlace que presentan y su fortaleza. La siguiente tabla resume de modo comparativo las principales propiedades:
Referencias
Quimitube.com,. (2014). Enlace Químico
| Quimitube. Retrieved 4
November 2014, from http://www.quimitube.com/videoscategory/enlace-quimico




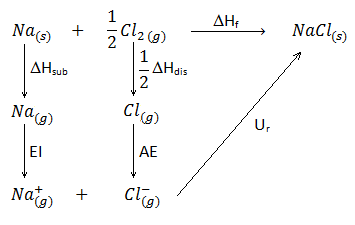
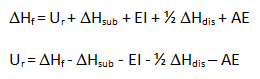



















No hay comentarios:
Publicar un comentario