Conceptos clave:
- Antecedentes del modelo atómico de Bohrü
- Teoría cuántica de Planck.ü
- Efecto fotoeléctrico.ü
- Espectros atómicos.ü
- Modelo atómico de Bohr.ü
- Antecedentes del modelo cuántico del átomoü
- Dualidad onda-partícula.ü
- Principio de incertidumbre.ü
- Modelo cuántico del átomo.ü
- Orbitales. ü
- Números cuánticos. ü
- Principio de exclusión de Pauli. ü
- Configuraciones electrónicas. ü
- Sistema periódico. ü
- Propiedades periódicas.
- Volumen/radio atómico
- Potencial de ionización
- Afinidad electrónica
- Electronegatividad
Objetivos del tema:
- Dar la composición subatómica de un nucleido cargado o neutroü
- Describir el modelo de Bohrü
- Relacionar los espectros atómicos con el modelo atómico de Bohrü
- Describir los hechos experimentales que condujeron al modelo cuánticoü
- Describir y dibujar los orbitales atómicos y los números cuánticos que los definen ü
- Escribir configuraciones electrónicas de átomos polielectrónicos y el conjunto de números cuánticos del electrón diferenciadorü
- Conocer la evolución de la clasificación de los elementosü
- Relacionar la tabla periódica y la configuración electrónica de los elementosü
- Definir las propiedades periódicas, describir y justificar su variación a lo largo de la tabla periódica en función de la carga nuclear efectiva.
1. Estructura atómica
Artículo de V. Jiménez sobre el aparato de Sánchez.
Instrucciones originales del Aparato de Sánchez.
Folleto informativo sobre el Aparato de Sánchez y sus accesorios.
Catálogo de la exposición de la MUNCYT dedicada a Mónico Sánchez
Instrucciones originales del Aparato de Sánchez.
Folleto informativo sobre el Aparato de Sánchez y sus accesorios.
Catálogo de la exposición de la MUNCYT dedicada a Mónico Sánchez
Antecedentes del modelo de Bohr
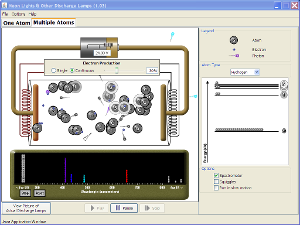
- Espectros atómicos. Desde finales del S. XIX, se conocía que los elementos emitían una luz característica bajo excitación. Este hecho se utilizaba desde tiempo inmemorial en los fuegos artificiales, y con fines analíticos en los ensayos a la llama de metales:
- El elemento más estudiado era el más simple, el hidrógeno, y se disponía de una expresión desarrollada por Rydberg, que predecía la posición de las líneas del espectro. Sin embargo, los modelos del átomo vigentes no eran capaces de explicar este hecho.
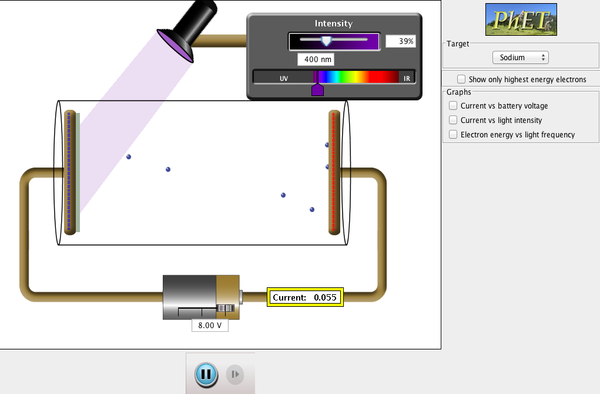
- Efecto fotoeléctrico. Se había descubierto que ciertos metales emitían electrones cuando eran iluminados, cosa que no se entendía. Las características de este fenómeno eran:
- La existencia de una frecuencia umbral para el comienzo de la emisión.
- Un aumento de la intensidad de la luz extrae más electrones, pero todos de la misma energía.
- Un aumento de la frecuencia extrae los mismos electrones, pero de mayor energía.
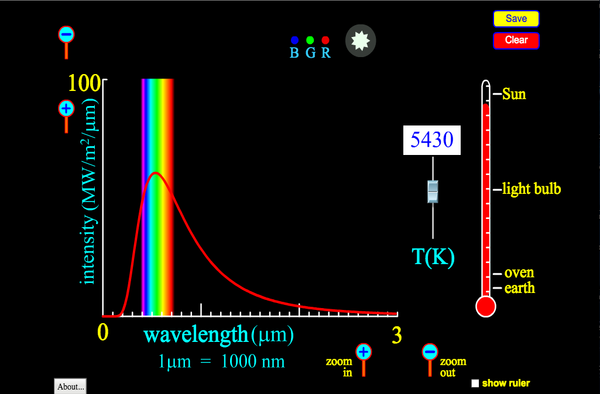
- Espectro de emisión del cuerpo negro. Todos los cuerpos emiten energía por el hecho de estar a una determinada temperatura, independientemente del material de que esté hecho. El espectro de emisión de estos cuerpos era una curva parecida a una gaussiana, con un máximo que se desplaza hacia el UVA al aumentar la temperatura, al tiempo que la cantidad de energía emitida crece también. En la época existía una teoría de la emisión de energía que era incapaz de reproducir el máximo y posterior descenso de la emisión (catástrofe del UVA) y varias expresiones empíricas que describían aspectos del fenómeno pero no existía un teoría que les diera soporte.
Postulados del modelo atómico de Bohr
- Cualquiera que sea la órbita descrita por un electrón, éste no emite energía radiante.
- Únicamente son posibles aquéllas órbitas para las cuales el momento angular del electrón es un múltiplo entero de h/2p.
- La energía liberada al caer el electrón de una órbita superior a otra más cercana al núcleo, se emite en forma de una onda electromagnética elemental, un fotón.
- El modelo de Bohr predice una serie de órbitas circulares cada vez más separadas entre sí y cada vez de mayor energía. Además, predice el valor experimental de la constante de Rydberg con un error inferior al 1 %.
La principal limitación del modelo es que sólo se puede aplicar a átomos monoelectrónicos, y posteriores refinamientos del modelo continúan teniendo los mismos problemas, lo que aboca a un nuevo enfoque.
Antecedentes del modelo cuántico
- Dualidad onda partícula. De Broglie postuló que la doble naturaleza observada en la luz podría ser extensible a toda la materia que de esta forma, también tendría naturaleza de onda.
- Principio de incertidumbre de Heisenberg. El principio de incertidumbre establece la imposibilidad de conocer con absoluta certeza determinadas magnitudes como por ejemplo la posición y la velocidad de un partícula.
Modelo cuántico del átomo
El modelo cuántico del átomo se basa en considerar que el electrón en el entorno del núcleo atómico se comporta como una onda, y entonces, aplicarle el formalismo de las ecuaciones de onda, pasadas por el tamiz de las nuevas ideas cuánticas. El resultado se conoce como ecuación de Schrödinger, en honor al físico austriaco que abordó el problema por primera vez:
Al resolver la ecuación diferencial de segundo grado, se obtienen simultáneamente las funciones de onda Y, y los valores de energía asociados a cada una de ellas.
Es importante resaltar en este momento el hecho de que la función de onda es la descripción matemática del comportamiento del electrón, es decir, contiene toda la información sobre el comportamiento del electrón, pero no tiene realidad física, no es una cosa. Este problema fue solventado por Max Born, quien interpretó el cuadrado de la la función de onda como una función de densidad de probabilidad. Aceptando ese hecho, se puede definir un nuevo concepto, el de orbital, que sería la zona del espacio, asociada al cuadrado de una función de onda, en la que existe una determinada probabilidad (generalmente el 90 %) de encontrar al electrón descrito por aquella. En la mecánica cuántica, los orbitales sustituyen a las órbitas.
La función de onda Y, y por lo tanto el orbital, dependen de las variables espaciales (x, y, z) pero además, están parametrizados por otros tres valores que denominaremos números cuánticos (n, l, m) y que determinan sus características: Ynlm(x,y,z).
Los números cuánticos solo pueden adoptar unos valores determinados, y además, son dependientes unos de otros. Cada uno de ellos además, determina una de las características de la función de onda.
- n, o número cuántico principal; toma todos los valores de los números naturales, y determina fundamentalmente la energía del electrón en el orbital correspondiente
- l, o número cuántico secundario; toma todos los valores enteros entre 0 y n-1, y determina parcialmente la energía del electrón y la forma del orbital, habitualmente, el número cuántico l se representa por una letra de acuerdo con la siguiente equivalencia:
s p d f

- m, o número cuántico magnético; toma todos los valores enteros entre -l y +l, y determina la orientación del orbital
Con posterioridad, Pauli introdujo un cuarto número cuántico, asociado no ya a los orbitales, sino a los electrones que los ocupan, el número cuántico de spin, s, que adopta sólo dos valores: ±1/2.
La siguiente tabla muestra las combinaciones de valores permitidos de los números cuánticos para los electrones de un átomo :

Este dibujo muestra algunos orbitales atómicos típicos:
En esta WEB se pueden ver más orbitales de otros niveles e incluso bajarse un programa para visualizarlos de diferentes formas.
Configuraciones electrónicas
Si pensamos en cómo se distribuirían los electrones de los diferentes átomos, empezando por el H, el problema inicial es sencillo:
H: 1s1
Sin embargo, con solo tener 2 electrones (He), salta una pregunta, ¿dónde ponemos ese electrón?
Para poder responder necesitamos saber varias cosas: el orden de llenado de los orbitales, el número de electrones que caben en cada orbital, y cómo se distribuyen en ellos. Todo ello viene dictado por los siguientes principios:
- Principio de "aufbau" (construcción): nos dice que los orbitales se llenan en orden creciente de energía. Ese orden de energía es el que viene dictado por la suma n+l, y a igualdad de ese valor, por orden creciente de n. Aplicándolo, el orden sería: 1s (1+0), 2s (2+0), 2p (2+1), 3s (3+0), 3p (3+1), 4s (4+0), 3d (3+2), 4p (4+1),... Hay una regla nemotécnica para ello denominada diagrama de Möeller:
- Principio de exclusión de Pauli: establece que en un orbital sólo pueden existir dos electrones con spines opuestos, por lo tanto limita a dos el número de electrones por orbital.
- Principio de máxima multiplicidad de Hund: establece que los electrones se distribuyen por los orbitales de modo que los spines estén lo más desapareados posibles, es decir, que antes de poner un segundo electrón en un orbital de un subnivel, todos los demás deben tener uno.
Aplicando estos principios, podemos ir dando las configuraciones de los siguientes elementos:
He: 1s2
Li: 1s2 2s1
Be: 1s2 2s2
B: 1s2 2s2 2p1
C: 1s2 2s2 2p2
Cada uno de los electrones de un átomo se puede identificar por un cuarteto de números cuánticos: los tres del orbital en que se sitúe más el de spin. El último electrón que se coloca en la configuración de un átomo y que lo diferencia del precedente y del posterior se denomina electrón diferenciador.
La tabla periódica
La tabla periódica de los elementos clasifica a los mismos por orden creciente de número atómico, haciendo coincidir verticalmente a sustancias con similares propiedades químicas, lo que refleja a la postre una coincidencia de las configuraciones electrónicas de las mismas, como se ha indicado en la presentación anterior, y de hecho, es posible escribir la configuración electrónica de cualquier elemento, conociendo su posición en la tabla.
Las filas de la tabla se denominan periodos y a lo largo de ellos hay una serie de propiedades que evolucionan de forma similar al compararlos entre sí. Las columnas se llaman grupos y los elementos de un mismo grupo tienen la misma configuración electrónica en la capa de valencia, lo que determina propiedades químicas muy similares entre sí. Algunos de los grupos tienen nombres característicos: grupo 1, alcalinos; grupo 2, alcalinotérreos; grupos 3 a 12, metales de transición; grupo 13, térreos; grupo 16, anfígenos; grupo 17, halógenos; y grupo 18 gases nobles. Las dos series de 14 elementos que se suelen situar por comodidad fuera de la tabla se denominan lantánidos (periodo 6) y actínidos (periodo 7).
Webelements.com
Ptable.com
Webelements.com
Ptable.com
Cartogramas, por Prof. Mark Winter, Universidad de Sheffield
TED-Ed and Periodic Videos
The Periodic Table of Videos
TED-Ed and Periodic Videos
The Periodic Table of Videos
Periodicidad en los grupos:
Periodicidad en los periodos: En esta WEB podéis explorar la periodicidad a lo largo del tercer periodo.
Propiedades periódicas
Las propiedades periódicas clásicas son cuatro:
- radio atómico, definido como la mitad de la distancia entre los centros de dos átomos vecinos iguales
- potencial de ionización, energía necesaria para arrancarle un electrón al átomo en estado gaseoso
- afinidad electrónica, energía desprendida cuando un átomo en fase gaseosa acepta un electrón transformándose en un anión
- electronegatividad, tendencia de un átomo a atraer hacia sí los electrones compartidos en un enlace
En este ENLACE se puede descargar un fichero con los datos y gráficos de las cuatro propiedades periódicas clásicas.
La variación del radio atómico se puede explicar del siguiente modo: conforme bajamos en un grupo, aumenta el número de capas que tiene el átomo, y por lo tanto, su tamaño; conforme avanzamos en un periodo, lo que aumenta es el número atómico, por lo que los electrones, que están rellenando progresivamente la capa correspondiente (o una capa inferior en el caso de los metales de transición) se ven más fuertemente atraídos por el núcleo y por eso el tamaño disminuye.
La variación del potencial de ionización se puede explicar aludiendo al tamaño del átomo que hemos visto antes: cuanto más lejos esté el electrón, menos energía hará falta para arrancárselo al átomo, y a la inversa. Por eso, la variación del potencial de ionización es la inversa a la del radio atómico.
Otro tanto cabe decir de la afinidad electrónica, que puede verse como el potencial de ionización del anión correspondiente, cambiado de signo,y que por lo tanto, cabe esperar que se comporte igual que el potencial de ionización, y por los mismos motivos.
Finalmente, la electronegatividad, que también varía como el potencial de ionización y la afinidad electrónica. Si pensamos en qué es la electronegatividad, es fácil darse cuenta de que mide a la vez esas dos propiedades, y por ello no es sorprendente que varíe como ellas.
En resumen, el comportamiento periódico de estas propiedades viene gobernado por la carga del núcleo y el tamaño del átomo.
La variación del radio atómico se puede explicar del siguiente modo: conforme bajamos en un grupo, aumenta el número de capas que tiene el átomo, y por lo tanto, su tamaño; conforme avanzamos en un periodo, lo que aumenta es el número atómico, por lo que los electrones, que están rellenando progresivamente la capa correspondiente (o una capa inferior en el caso de los metales de transición) se ven más fuertemente atraídos por el núcleo y por eso el tamaño disminuye.
La variación del potencial de ionización se puede explicar aludiendo al tamaño del átomo que hemos visto antes: cuanto más lejos esté el electrón, menos energía hará falta para arrancárselo al átomo, y a la inversa. Por eso, la variación del potencial de ionización es la inversa a la del radio atómico.
Otro tanto cabe decir de la afinidad electrónica, que puede verse como el potencial de ionización del anión correspondiente, cambiado de signo,y que por lo tanto, cabe esperar que se comporte igual que el potencial de ionización, y por los mismos motivos.
Finalmente, la electronegatividad, que también varía como el potencial de ionización y la afinidad electrónica. Si pensamos en qué es la electronegatividad, es fácil darse cuenta de que mide a la vez esas dos propiedades, y por ello no es sorprendente que varíe como ellas.
En resumen, el comportamiento periódico de estas propiedades viene gobernado por la carga del núcleo y el tamaño del átomo.










.png)
No hay comentarios:
Publicar un comentario